家畜疫病病原生物学研究中心
家畜疫病病原生物学研究中心(以下简称“病原中心”),于2021年5月筹备建设,2022年11月正式成为研究所二级内设机构序列之一。病原中心设负责人1名,即病原中心常务副主任。研究所所长兼任病原中心主任。病原中心目前设办公室1个、独立PI科研课题组4个,下辖科研支撑平台1个,管理科研平台9个,管理服务兰州大学青年研究员3名。 1. 负责动物疫病防控全国重点实验室、农业农村部动物病原生物学与疫病防控学科群、甘肃省动物寄生虫病重点实验室、甘肃省病原生物学基础学科研究中心、甘肃省协同创新基地、兰州市专家人才工作站、研究所科学技术协会、西北动物免疫前沿科学中心(筹)等平台建设及运行管理; 2. 负责以平台为依托的科技项目组织实施与管理; 3. 组织实施科普开放活动; 4. 组织召开学术委员会及学术研讨会等; 5. 负责各平台考核评估工作。 1. 负责协调对接所内职能部门与课题组PI,做好基础服务工作,保障课题组之间协同创新和联合攻关。 2. 配合兰州大学动物医学与生物安全学院暂时管理和服务兰州大学青年研究员实验室及人员。 1.与相关职能部门配合,引进独立PI和柔性引进高端人才,支撑壮大研究所科技创新力量。 2.以家畜重大疫病为研究对象,针对病毒、细菌、寄生虫类疫病开展病原学及病原与宿主、环境相互作用规律等研究。 负责实现大型仪器设备的高效使用、功能开发、升级改造等,支撑高水平科研成果产出。 病原中心现有人员83人,其中病原中心内部人员80人(正式职工25名,科研助理5名,博硕研究生50名),兰州大学青年研究员3人。正式职工中,博士学位16人、硕士学位8人、学士学位1人。 办公室人员5人 中心仪器室6人 课题组69人(见下文) 五、课题组简介 课题组现有人员14人。柔性首席科学家1人、独立PI 2人、优秀博士2人、博士研究生2人、硕士研究生5人、科研助理2人。 研究方向及内容 研究重大动物疫病病原与重要人畜共患病病原免疫及致病机制,研发相关mRNA疫苗,为国家重大疫病防控提供理论基础和技术支撑。病原包括新发传染病病毒如非洲猪瘟、牛结节性皮肤病病毒等,重要致病菌如结核杆菌、布鲁氏菌等。 1.舒红兵 中国科学院院士,发展中国家科学院院士,兰州兽医研究所家畜疫病病原生物学研究中心首席科学家。先后担任多项国家科技部项目首席科学家、国家自然科学基金委创新群体和基础科学中心等项目负责人。曾获《自然》杰出导师奖,国家自然科学二等奖两项,中国细胞生物学学会杰出成就奖等奖励与荣誉。在病毒免疫与炎症等领域取得了原创性、系统性成果,在国际重要期刊发表论文190余篇,被引用2万余次。已培养研究生70余人,博士后17人,其中34人晋升高级职称,9人入选国家级人才称号。 主要研究方向:研究重大动物疫病病原与重要人畜共患病病原免疫及致病机制,研发相关mRNA疫苗。 电子邮箱:shuh@whu.edu.cn 2.吴欣 博士,研究员(所聘),兰州兽医研究所“青年英才计划”入选者。武汉大学博士,南加州大学和克利夫兰医学中心博士后。在Nat Commun、mBio、J Immunol 等期刊发表论文8篇。 主要研究方向:人兽共患病原感染与致病机制研究,设计开发新型疫苗。 电子邮箱:wuxin@caas.cn 3.夏天 博士,研究员(所聘),兰州兽医研究所“青年英才计划”入选者。武汉大学博士,南加州大学和克利夫兰医学中心博士后。在PNAS、PLOS PATHOG等期刊发表论文多篇。 主要研究方向:动物病原与宿主相互作用、致病以及免疫逃逸机制研究,开展针对重要病原的mRNA疫苗研发。 电子邮箱:xiatian02@caas.cn 4.杨钰林 博士,副研究员(所聘)。本科毕业于南方医科大学,硕博连读于武汉大学。博士期间一直致力于抗病毒天然免疫与细胞内信号传导研究,相关成果发表在PNAS、CM、JMCB等著名国际期刊。 主要研究方向:以牛结节性皮肤病病毒为主要模式病原,从病毒蛋白调节宿主天然免疫反应的层面,阐明病原体与宿主相互作用的机制。 电子邮箱:yangyulin@caas.cn 5.曹立波 博士,副研究员(所聘)。博士毕业于武汉大学,博士期间主要从事激素对肿瘤免疫调节作用以及抗病毒天然免疫方面的研究,相关成果发表在JMCB、PNAS、CMI等国际期刊。 主要研究方向:以布鲁氏菌牛结节性皮肤病病毒为主要病原模型,围绕重要家畜病原与宿主相互作用这一核心,研究病原对宿主细胞的免疫调节机制和死亡调节机制。 电子邮箱:caolibo01@caas.cn 1. Yang Y, Chen YZ, & Xia T* (2024). Optimizing antigen selection for the development of tuberculosis vaccines. Cell Insight. 100163. 2. Yang JK, Wang Y, Hou YP, Sun MY, Xia T, & Wu X* (2023). Evasion of host defense by Brucella. Cell Insight. 100143. 3. Xia T, Wu X, Hong E, Jung K, Lai CJ., Kwak MJ., ... & Jung J. U. (2023). Glucosylceramide is essential for Heartland and Dabie bandavirus glycoprotein-induced membrane fusion. PLoS Pathog. 19(3), e1011232. 4. Hu MM, Shu HB* (2023). Mitochondrial DNA-triggered innate immune response: mechanisms and diseases. Cell Mol Immunol. 20(12):1403-1412. 5. Liu R, Zeng LW, Li HF, Shi JG, Zhong B, Shu HB* & Shu Li* (2023). PD-1 signaling negatively regulates the common cytokine receptor γ chain via MARCH5-mediated ubiquitination and degradation to suppress anti-tumor immunity. Cell Res. 33(12):923–939. 6. Cao LB, Ruan ZL, Yang YL, Zhang NC, Gao C, Cai CG, Zhang J, Hu MM*, Shu HB* (2023). Estrogen receptor α-mediated signaling inhibits type I interferon response to promote breast cancer. J Mol Cell Biol. 13:mjad047. 7. Guo Y, Zhang XN, Su S, Ruan ZL, Hu MM*, Shu HB* (2023). β-adrenoreceptor-triggered PKA activation negatively regulates the innate antiviral response. Cell Mol Immunol. 20(2):175-188. 8. Wu X, Xia T, Shin WJ, Yu KM, Jung W, Herrmann, A., ... & Jung, J. U. (2022). Viral mimicry of interleukin-17A by SARS-CoV-2 ORF8. Mbio. 13(2), e00402-22. 9. Yang YL#, Cao LB#, He WR#, Zhong L, Guo Y, Yang Q, Shu HB, and Hu MM*(2022). Endocytosis triggers V-ATPase-SYK-mediated priming of cGAS activation and innate immune response. Proc Natl Acad Sci U S A. 119, e2207280119. 10. Zhong B, Shu HB* (2022). MITA/STING-mediated antiviral immunity and autoimmunity: the evolution, mechanism, and intervention. Curr Opin Immunol. 78:102248. 11. Su S#, Hua D#, Li JP#, Zhang XN, Bai L, Cao LB, Guo Y, Zhang M, Dong JZ, Liang XW, Lan K, Hu MM*, Shu HB* (2022). Modulation of innate immune response to viruses including SARS-CoV-2 by progesterone. Signal Transduct Target Ther. 7(1):137. 12. Feng L, Li C, Zeng LW, Gao D, Sun YH, Zhong L, Lin H, Shu HB*, Li S* (2022). MARCH3 negatively regulates IL-3-triggered inflammatory response by mediating K48-linked polyubiquitination and degradation of IL-3Rα. Signal Transduct Target Ther. 7(1):21. 13. Lin H, Feng L, Cui KS, Zeng LW, Gao D, Zhang LX, Xu WH, Sun YH, Shu HB*, Li S* (2021). The membrane-associated E3 ubiquitin ligase MARCH3 downregulates the IL-6 receptor and suppresses colitis-associated carcinogenesis. Cell Mol Immunol. 18(12):2648-2659. 14. Zhong L, Shu HB* (2021). Mitotic inactivation of the cGAS‒MITA/STING pathways. J Mol Cell Biol. 13(10):721-727. 15. Li C, Feng L, Luo WW, Lei CQ, Li M, Shu HB* (2021). The RNA-binding protein LUC7L2 mediates MITA/STING intron retention to negatively regulate innate antiviral response. Cell Discov. 7(1):46. 16. He WR, Cao LB, Yang YL, Hua D, Hu MM, Shu HB* (2021). VRK2 is involved in the innate antiviral response by promoting mitostress-induced mtDNA release. Cell Mol Immunol. 18(5):1186-1196. 17. Song ZM, Lin H, Yi XM, Guo W, Ming-Ming Hu, Shu HB* (2020). KAT5 acetylates cGAS to promote innate immune response to DNA virus. Proc Natl Acad Sci U S A. 117(35):21568-21575. 18. Zhong L, Hu MM, Bian LJ, Liu Y, Chen Q and Shu HB* (2020). Phosphorylation of cGAS by CDK1 impairs self-DNA sensing in mitosis. Cell Discov. 28:6:26. 19. Li M, Shu HB* (2020). Dephosphorylation of cGAS by PPP6C impairs its substrate binding activity and innate antiviral response. Protein Cell. 11(8):584-599. 20. Liao Chen-Yang, Lei Cao-Qi, Shu HB* (2020). PCBP1 modulates the innate immune response by facilitating the binding of cGAS to DNA. Cell Mol Immunol. 18(10):2334-2343. 21. Zhong X, Feng L, Zang R, Lei Cao-Qi, Yang Qing, Shu HB* (2020). ZFYVE1 negatively regulates MDA5- but not RIG-I-mediated innate antiviral response. PLoS Pathog. 16(4):e1008457. 22. Zang R, Lian H, Zhong X, Yang Q*, Shu HB* (2020). ZCCHC3 modulates TLR3-mediated signaling by promoting recruitment of TRIF to TLR3. J Mol Cell Biol. 12(4):251-262. 23. Yang Q, Shu HB* (2020). Deciphering the pathways to antiviral innate immunity and inflammation. Adv Immunol. 145:1-36. 24. Xia T, Yi XM, Wu X, Shang J, & Shu, HB* (2019). PTPN1/2-mediated dephosphorylation of MITA/STING promotes its 20S proteasomal degradation and attenuates innate antiviral response. Proc Natl Acad Sci U S A. 116(40), 20063-20069. 25. Wu X, Lei C, Xia T, Zhong X, Yang Q, & Shu HB* (2019). Regulation of TRIF-mediated innate immune response by K27-linked polyubiquitination and deubiquitination. Nat Commun. 10(1), 4115. 1. 甘肃省科技重大专项项目:重要病原体与家畜宿主天然免疫相互作用研究(22ZD6NA001),2022-11-11 - 2025-11-10,300万元。 2. 甘肃省基础研究创新群体项目:重要家畜病原体与宿主相互作用基础研究创新群体(23JRRA561),2023-07-01 - 2026-06-30,80万元。 3. 甘肃省科技重大专项项目:2022年甘肃省动物用生物制品创新联合体项目 家畜重要疫病诊断试剂研制与产业化(22ZD6NA012-3-1),2022-11-11 - 2025-11-10,45万元。 4. 兰州大学动物医学与生物安全学院建设发展基金——山东信得科研项目:猫传染性腹膜炎病毒mRNA疫苗研发,2023-10 - 2024-10,60万元。 课题组现有人员36人,其中,课题组长(独立PI )1人、引进优秀博士1人、博士后4人(其中2名博士后为联合培养)、博士研究生6人、硕士研究生24人。 猪重要疫病防控研究课题组聚焦国家对猪繁殖与呼吸综合征、病毒性腹泻等严重危害养猪业的重要疫病防控的重大科技需求,主要开展如下四个方向的研究: (1)病原流行传播与变异演化机制:系统开展猪繁殖与呼吸综合征、病毒性腹泻等猪重要病毒性疫病的流行病学和传播机制研究;研究相关病毒遗传变异、演化的特征与其分子机制。为猪重要疫病防控产品创制与防控策略制定提供基础材料与科学依据。 (2)病原的大分子结构与功能解析:系统研究猪繁殖与呼吸综合征病毒、腹泻相关病毒等猪重要病毒的病原组学与调控网络,解析病毒的大分子结构、功能与其调控机制。为深入理解猪重要疫病的病原感染与致病机制及其防控产品创制提供理论依据。 (3)病原感染致病与宿主抗病机制:从病毒与宿主相互作用角度,系统研究猪繁殖与呼吸综合征病毒、腹泻相关病毒等猪重要病毒的感染复制增殖与致病机制;解析宿主抗重要病毒感染的免疫应答与免疫保护机理。为猪重要疫病防控产品创制与防控策略制定提供理论依据。 (4)防控产品创制与防控策略研究:创制猪繁殖与呼吸综合征、病毒性腹泻等猪重要病毒性疫病的新型高效疫苗、新型诊断技术与有效抗病毒药物;发掘与编辑猪对重要疫病的抗性/易感基因与抗病育种;建立猪重大疫病综合防控与净化根除技术体系。为猪重要病毒性疫病有效防控与净化根除提供产品保障与技术支撑。 1.石正旺 男,1990年生,甘肃白银人,博士,副研究员(所聘)。2023年6月于甘肃农业大学获农学博士学位。2023年8月至今在中国农业科学院兰州兽医研究所从事动物疫病诊断方面工作。现主要从事非洲猪瘟、口蹄疫、猪流行性腹泻等疫病精准、快速诊断相关研究。以第一参与作者在Appl Microbiol Biotechnol、Transbound Emerg Dis、Virol Sin等期刊上发表SCI 论文11余篇。获国家发明专利4项、三类新兽药证书1项、国家标准1项。 主要研究方向:动物疫病诊断 电子邮箱:shizhengwang@caas.cn 2.郑紫方 男,1992年生,河南驻马店人,博士。2016年6月于河南农业大学获医学学士学位,2019年6月于西北农林科技大学获农学硕士学位,2022年12月于西北农林科技大学获农学博士学位。2023年3月至今在中国农业科学院兰州兽医研究所从事博士后研究工作,现从事猪繁殖与呼吸综合征病毒感染与致病机制和宿主抗病毒机制相关研究,研究成果以第一作者发表于Journal of Virology。 主要研究方向:猪繁殖与呼吸综合征病毒感染与致病机制和宿主抗病毒机制。 电子邮箱:zhengzifang@caas.cn 3.李志伟 男,1993年生,河南鹤壁人,博士。中国农业科学院“博士后优农计划”入选者。2017年6月于西北农林科技大学获农学学士学位,2020年6月于西北农林科技大学获农学硕士学位,2023年9月于西北农林科技大学获兽医博士学位。2023年10月至今在中国农业科学院兰州兽医研究所从事博士后工作。现主要从事猪流行性腹泻病毒(PEDV)嗜性、致病和免疫的分子机制等相关研究。利用反向遗传操作技术阐明了PEDV细胞嗜性的分子机制并鉴定出E蛋白为其新毒力因子。以第一或并列第一作者在mBio、Journal of virology、Microbial Pathogenesis等期刊上发表多篇SCI论文。 主要研究方向:猪流行性腹泻病毒(PEDV)嗜性、致病和免疫的分子机制;PEDV传统和新型疫苗研发。 电子邮箱:877304034@qq.com 研究进展或成果 论文——1. Xiao Liu#, Yinan Meng#, Jianyu He, Xuelian Jiang, Shuangquan Zhang, Dan Wang, Yanan Zhu, Zifang Zheng, Yunpeng Fan, Yupeng Yin*, Shuqi Xiao*. Natural compound Sanggenon C inhibits porcine reproductive and respiratory syndrome virus replication in piglets. Veterinary Microbiology, 2024, 290:109991. 2. Xuyang Guo#, Yingtong Feng#, Xiaojing Zhao, Shuang Qiao, Zhiqian Ma, Zhiwei Li, Haixue Zheng, Shuqi Xiao*. Coronavirus Porcine Epidemic Diarrhea Virus Utilizes Chemokine Interleukin-8 to Facilitate Viral Replication by Regulating Ca2+ Flux. Journal of Virology, 2023, 97(5):e0029223. 3. Zhiwei Li#, Zhiqian Ma#, Weiguo Han, Chuanzhe Chang, Yang Li, Xuyang Guo, Zifang Zheng, Yingtong Feng, Lele Xu, Haixue Zheng, Xinglong Wang*, Shuqi Xiao*. Deletion of a 7-amino-acid region in the porcine epidemic diarrhea virus envelope protein induces higher type I and III interferon responses and results in attenuation in vivo. Journal of Virology, 2023, 97(9):e0084723. 4. Yang Li#, Lele Xu#, Dian Jiao, Zifang Zheng, Zhihao Chen, Yang Jing, Zhiwei Li, Zhiqian Ma, Yingtong Feng, Xuyang Guo, Yumiao Wang, Yuan He, Haixue Zheng, Shuqi Xiao*. Genomic similarity and antibody-dependent enhancement of immune serum potentially affect the protective efficacy of commercial MLV vaccines against NADC30-like PRRSV. Virologica Sinica, 2023, 38(5):813-826. 5. Huaguo Huang#, Wen Dang#, Zhengwang Shi, Mingyang Ding, Fan Xu, Tao Li, Tao Feng, Haixue Zheng*, Shuqi Xiao*. Identification of African swine fever virus MGF505-2R as a potent inhibitor of innate immunity in vitro. Virologica Sinica, 2023, 38(1):84-95. 6. Xiao Liu#, Yanan Zhu#, Dan Wang, Ran Feng, Zhihao Chen, Zifang Zheng, Yang Li, Lele Xu, Haixue Zheng, Yunpeng Fan*, Yupeng Yin*, Shuqi Xiao*. The natural compound Sanggenon C inhibits PRRSV infection by regulating the TRAF2/NF-κB signalling pathway. Veterinary Research, 2023, 54(1):114. 7. Zhengwang Shi, Liyan Cao, Juncong Luo, Gaijing Zhou, Qingshan Zuo, XiangTao Liu, Yonghao Hu*, Hong Tian*, Haixue Zheng*. A chemiluminescent magnetic microparticle immunoassay for the detection of antibody against African swine fever virus. Applied microbiology and biotechnology, 2023, 107(11):3779-3788. 8. Zhiwei Li#, Zhiqian Ma#, Linfang Dong, Ting Yang, Yang Li, Dian Jiao, Weiguo Han, Haixue Zheng, Shuqi Xiao*. Molecular mechanism of porcine epidemic diarrhea virus cell tropism. mBio, 2022, 13(2): e0373921. 9. Zifang Zheng#, Xiali Fu#, Xue Ling, Huanhuan Sun, Yang Li, Zhiqian Ma, Bingjie Wei, Haixue Zheng, Shuqi Xiao*. Host Cells Actively Resist Porcine Reproductive and Respiratory Syndrome Virus Infection via the IRF8-MicroRNA-10a-SRP14 Regulatory Pathway. Journal of Virology, 2022, 96(7):e0000322. 10. Yingtong Feng#, Xuyang Guo#, Hong Tian#, Yuan He, Yang Li, Xuelian Jiang, Haixue Zheng*, Shuqi Xiao*. Induction of HOXA3 by Porcine Reproductive and Respiratory Syndrome Virus Inhibits Type I Interferon Response through Negative Regulation of HO-1 Transcription. Journal of Virology, 2022, 96(3):e0186321. 11. Yang Li#, Dian Jiao#, Yang Jing, Yuan He, Weiguo Han, Zhiwei Li, Zhiqian Ma, Yingtong Feng, Shuqi Xiao*. Genetic characterization and pathogenicity of a novel recombinant PRRSV from lineage 1, 8 and 3 in China failed to infect MARC-145 cells. Microbial Pathogenesis, 2022, 165:105469. 12. Bo Yang, Zhengwang Shi, Yuan Ma, Lijuan Wang, Liyan Cao, Juncong Luo, Ying Wan, Rui Song, Yiyong Yan, Kehu Yuan, Hong Tian, Haixue Zheng*. LAMP assay coupled with CRISPR/Cas12a system for portable detection of African swine fever virus. Transboundary and Emerging Diseases, 2022, 69(4):e216-e223. 13. Gaijing Zhou, Zhengwang Shi, Juncong Luo, Liyan Cao, Bo Yang, Ying Wan, Lijuan Wang, Rui Song, Yuan Ma, Hong Tian*, Haixue Zheng*. Preparation and epitope mapping of monoclonal antibodies against African swine fever virus P30 protein. Applied microbiology and biotechnology, 2022, 106(3):1199-1210. 14. Ying Wan, Zhengwang Shi, Gaochaung Peng, Lijuan Wang, Juncong Luo, Yi Ru, Gaijing Zhou, Yuan Ma, Rui Song, Bo Yang, Liyan Cao, Hong Tian*, Haixue Zheng*. Development and application of a colloidal-gold dual immunochromatography strip for detecting African swine fever virus antibodies. Applied microbiology and biotechnology, 2022, 106(2):799-810. 15. Lele Xu,Zhiqian Ma,Yang Li,Zhaoxia Pang,Shuqi Xiao*. Antibody dependent enhancement: Unavoidable problems in vaccine development. Advances in Immunology, 2021, 151:99-133. 16. Yang Li#, Gaoxiao Xu#, Xingqian Du, Lele Xu, Zhiqian Ma, Zhiwei Li, Yingtong Feng, Dian Jiao, Wenping Guo, Shuqi Xiao*. Genomic characteristics and pathogenicity of a new recombinant strain of porcine reproductive and respiratory syndrome virus. Archives of Virology, 2021, 166(2):389-402. 17. Na Li, Ke Huang, Yujing Chen, Zhengyang Huang, Yiyi Zhang, ChaoLiang Leng,Yangkun Liu, Jianzhou Shi, Shuqi Xiao*, Lunguang Yao*. MicroRNA ssc-miR-124a exhibits antiviral activity against porcine reproductive and respiratory syndrome virus via suppression of host genes CD163. Veterinary Microbiology, 2021, 261: 109216. 18. Zhiqian Ma#, Zhiwei Li#, Linfang Dong, Ting Yang, Shuqi Xiao*. Reverse Genetic Systems: Rational Design of Coronavirus Live Attenuated Vaccines. Advances in Virus Research, 2020, 107:383-416. 19. Hong Duan#, Zhiqian Ma#, Lele Xu#, Angke Zhang, Zhiwei Li, Shuqi Xiao*. A novel intracellularly expressed NS5B-specific nanobody suppresses bovine viral diarrhea virus replication. Veterinary Microbiology, 2020, 240: 108449. 20. Zhiwei Li#, Zhiqian Ma#, Yang Li, Sheng Gao, Shuqi Xiao*. Porcine epidemic diarrhea virus: Molecular mechanisms of attenuation and vaccines. Microbial Pathogenesis, 2020, 149:104553. 21. Zhiqian Ma#, Tianyu Wang#, Zhiwei Li, Xuyang Guo, Yangsheng Tian, Yang Li, Shuqi Xiao*. A Novel Biotinylated Nanobody-based Blocking ELISA for the Rapid and Sensitive Clinical Detection of Porcine Epidemic Diarrhea Virus. Journal of Nanobiotechnology, 2019, 17(1):96. 22. Xiaobin Zhang#, Yingtong Feng#, Yunhuan Yan#, Zifang Zheng, Wenjing Wang, Yichi Zhang, En-min Zhou, Shuqi Xiao*. Cellular microRNA miR-c89 inhibits replication of porcine reproductive and respiratory syndrome virus by targeting the host factor porcine retinoid X receptor β. Journal of General Virology, 2019,100(10):1407-1416. 23. Zhiqian Ma#, Fengxing Pu#, Xiaobin Zhang, Yunhuan Yan, Lijuan Zhao, Angke Zhang, Na Li, En-Min Zhou, Shuqi Xiao*. Carbon Monoxide and Biliverdin Suppress Bovine Viral Diarrhoea Virus Replication. Journal of General Virology, 2017, 98(12):2982-2992. 24. Guangwei Zhao, Jianye Hou, Gaoxiao Xu, Aoqi Xiang, Yanmei Kang, Yunhuan Yan, Xiaobin Zhang, Gongshe Yang, Shuqi Xiao*, Shiduo Sun*. Cellular microRNA miR-10a-5p inhibits replication of porcine reproductive and respiratory syndrome virus by targeting the host factor signal recognition particle 14. Journal of General Virology, 2017, 98(4):624-632. 25. Angke Zhang#, Hong Duan#, Na Li, Lijuan Zhao, Fengxing Pu, Baicheng Huang, Chunyan Wu, Yuchen Nan, Taofeng Du, Yang Mu, Qin Zhao, Yani Sun, Gaiping Zhang, Julian A. Hiscox, En-Min Zhou*, Shuqi Xiao*. Heme oxygenase-1 metabolite biliverdin, not iron, inhibits porcine reproductive and respiratory syndrome virus replication. Free Radical Biology and Medicine, 2017, 102:149-161. 26. Angke Zhang#, Lijuan Zhao#, Na Li, Hong Duan, Hongliang Liu, Baicheng Huang, Fengxing Pu, Gaopeng Hou, Gaiping Zhang, En-Min Zhou*, Shuqi Xiao*. Carbon Monoxide Inhibits Porcine Reproductive and Respiratory Syndrome Virus Replication by the Cyclic GMP/Protein Kinase G and NF-κB Signaling Pathway. Journal of Virology, 2017, 91(1):e01866-16. 27. Shuqi Xiao#, Taofeng Du#, Xue Wang, Huaibao Ni, Yunhuan Yan, Na Li, Chong Zhang, Angke Zhang, Jiming Gao, Hongliang Liu, Fengxing Pu, Gaiping Zhang, En-Min Zhou*. MiR-22 promotes porcine reproductive and respiratory syndrome virus replication by targeting the host factor HO-1. Veterinary Microbiology, 2016,192:226-230. 28. Shuqi Xiao#, Xue Wang#, Huaibao Ni, Na Li, Angke Zhang, Hongliang Liu, Fengxing Pu, Lele Xu, Jiming Gao, Qin Zhao, Yang Mu, Chengbao Wang, Yani Sun, Taofeng Du, Xingang Xu, Gaiping Zhang, Julian A. Hiscox, Ian G. Goodfellow, En-Min Zhou*. MiR-24-3p Promotes Porcine Reproductive and Respiratory Syndrome Virus Replication through Suppression of Heme Oxygenase-1 Expression. Journal of Virology, 2015, 89(8):4494-4503. 29. Hongliang Liu#, Yan Wang#, Hong Duan, Angke Zhang, Chao Liang, Jiming Gao, Chong Zhang, Baicheng Huang, Qiongyi Li, Na Li, Shuqi Xiao*, En-Min Zhou*. An intracellularly expressed Nsp9-specific nanobody in MARC-145 cells inhibits porcine reproductive and respiratory syndrome virus replication. Veterinary Microbiology, 2015, 181(3-4):252-260. 30. Liangliang Wang#, Shuqi Xiao#, Jintao Gao, Meirui Liu, Xiaoyu Zhang, Ming Li, Guangyin Zhao, Delin Mo, Xiaohong Liu, Yaosheng Chen*. Inhibition of replication of porcine reproductive and respiratory syndrome virus by hemin is highly dependent on heme oxygenase-1, but independent of iron in MARC-145 cells. Antiviral research, 2014, 105(5):39-46. 31. Shuqi Xiao#, Angke Zhang#, Chong Zhang, Huaibo Ni, Jiming Gao, Chengbao Wang, Qin Zhao, Xiangpeng Wang, Xue Wang, Chao Ma, Hongliang Liu, Na Li, Yang Mu, Yani Sun, Gaiping Zhang, Julian A. Hiscox, Walter H. Hsu, En-Min Zhou*. Heme oxygenase-1 acts as an anti-viral factor for porcine reproductive and respiratory syndrome virus infection and over-expression inhibits virus replication in vitro. Antiviral Research, 2014,110:60-69. 32. 徐乐乐,李洋,李志伟,马志倩,肖书奇*. 病毒调节宿主适应性免疫的分子机制. 中国动物传染病学报,2021, 29(4):3-15. 33. 高胜#,李洋#,马志倩,李志伟,徐乐乐,焦点,冯英桐,杜兴乾,肖书奇*. PRRS减毒活疫苗抗体消长规律及仔猪最佳首免日龄的探究. 中国兽医学报,2021, 41(10):62-67. 34. 李洋#,高胜#,焦点,杜兴乾,徐乐乐,郑紫方,曹鑫宇,肖书奇*. PRRSV-VR2332减毒活疫苗不影响猪瘟疫苗和猪圆环病毒2型灭活疫苗诱导的抗体产生. 畜牧兽医学报,2021, 52(11):3175-3184. 35. 王丽娟,石正旺,杨波,麻园,罗俊聪,万颖,宋锐,田宏*,郑海学*. 抗非洲猪瘟病毒单链抗体的构建、表达及活性鉴定. 畜牧兽医学报,2021, 52(05):1328-1336. 36. 麻园,石正旺,罗俊聪,杨波,王丽娟,万颖,宋锐,曹丽艳,周改静,田宏,郑海学*,陈轶霞*. 猪瘟病毒化学发光抗体检测方法的建立与应用.畜牧兽医学报,2021, 52(06):1744-1752. 37. 万颖,罗俊聪,石正旺,麻园,王丽娟,杨波,宋锐,周改静,曹丽艳,田宏*,郑海学*. 猪瘟病毒抗体胶体金免疫层析试纸条的研制及初步应用. 中国兽医科学,2022, 52(01):1-10. 38. 周改静,罗俊聪,石正旺,万颖,杨波,曹丽艳,宋锐,田宏*,郑海学*. 非洲猪瘟病毒p30蛋白单克隆抗体的制备及阻断ELISA抗体检测方法的建立. 畜牧兽医学报,2022, 53(12):4337-4345. 39. 李洋#,杜兴乾#,李志伟,马志倩,焦点,荆扬,何员,冯英桐,肖书奇*. 规模化猪场PRRSV血清驯化对后备母猪生产性能的影响. 中国兽医学报,2022,42(10):2020-2089. 40. 林永玉,石正旺,罗俊聪,朱昱茜,席韬,周静,张帆,石鑫泰,王川*,田宏*,郑海学*. 赤羽病病毒N蛋白原核表达及单克隆抗体的制备. 生物工程学报,2024. 41. 朱昱茜,石正旺,罗俊聪,陈婕,林永玉,席韬,张帆,石鑫泰,郑海学*,包世俊*,田宏*. 南非2型口蹄疫病毒VP1蛋白单抗的制备与特性研究. 病毒学报,2024. 42. 荆扬#,王玉淼#,李洋,常辉,马志倩,李志伟,肖书奇* . 稳定表达PRRSV M蛋白的MARC-145 ORF6细胞系的构建及其对PRRSV增殖的影响. 畜牧兽医学报,2024. 兽药——1. 三类新兽药证书:郑海学,田宏,石正旺,杨帆,张克山,李丹,朱紫祥,茹毅,罗俊聪,刘华南,曹伟军,郭建宏,何继军,王丽娟,杨波,刘湘涛. 口蹄疫O型竞争ELISA抗体检测试剂盒,(2020)新兽药证字52号,2020.10. 专著——1. 于向春 肖书奇 刘拥军 主编,动物科学与动物医学专业英语(普通高等教育“十二五”精品课程建设教材),ISBN 978-7-5655-0965-0,中国农业大学出版社,410千字,2014年8月 2. 许信刚 邢福珊 主编,肖书奇 邱立 蒲鹏 副主编,兽医微生物学实验实习指导(第2版),西北农林科技大学出版社,292千字,2020年12月 3. 夏咸柱 钱 军 刘文森 主编,周恩民,肖书奇 等 参编,食品安全与病原微生物防控研究(中国工程院重点咨询项目),ISBN 978-7-03-047906-8,科学出版社,438千字,2016年3月 4. 农业农村部畜牧兽医局 编,肖书奇 等 参编,中国兽医科技发展报告(2015-2017年),ISBN 9787109248540,中国农业出版社,380千字,2018年12月 5. 科学技术部,邓小明 张改平 陈成 主编,郭晓宇,肖书奇,彭贵青 等执行编辑,动物用生物制品科技创新战略研究报告,ISBN 978-7-03-069176-7,科学出版社,378千字,2022年11月 标准——1. 郑振华,肖书奇,刘冬霞,韩晓刚,徐乐乐,秦书才,王普阳,赵江萌,吕妍. 饲料生产企业非洲猪瘟防控技术规范(Technical specification for prevention and control of African swine fever in feed production enterprises). 陕西省地方标准,标准编号:DB 61/T 1792-2023,发布日期2023年12月22日,实施日期2024年01月22日. 2. 刘思当,肖书奇,秦立廷,袁芳艳,陈婷,孟凡亮.规模化猪场简易化免疫程序制定技术指南(Technical guidelines for the development of simplified immunization procedures for Large-scale pig farm). 中国兽医协会团体标准,标准编号:T/CVMA 54-2020,2020年12月22日. 3. 刘小红,陈瑶生,刘长春,杨军香,肖书奇,黄萌萌,薛明. 标准化养殖场 生猪 (Standardization farm—Swine). 中华人民共和国农业行业标准化,标准编号:NY/T 2661-2014,中华人民共和国农业部. 中国农业出版社,2015年1月1日. 4. 郑海学,田宏,杨帆,石正旺,倪博,朱紫祥,张克山,李丹,罗俊聪,郭建宏,何继军,党文,靳野,刘华南,茹毅,曹伟军,刘永杰,张志,吴发兴,李晓成,刘湘涛,塞内卡病毒感染诊断技术,农业行业标准, 标准编号:NY/T3790-2020. 专利——1. 肖书奇,周恩民. HO-1和HO-1的诱导剂作为抑制PRRS病毒感染的新型阻断剂. ZL201310066567.4. 专利授权日:2016年05月04日. 2. 肖书奇,周恩民,张昂克. 一种胆绿素制剂及其在防治猪繁殖与呼吸综合征中的应用和检测方法. ZL201610866121.3. 专利授权日:2019年08月06日. 3. 肖书奇,周恩民,李娜. 一种抗PRRSV的microRNA样病毒小RNA序列及其用途和检测方法. ZL201610866123.2. 专利授权日:2019年09月04日. 4. 肖书奇,周恩民,李爽. 一种特异性结合BVD病毒非结构蛋白NS5B的纳米抗体及其应用. ZL201610892949.6. 专利授权日:2019年10月25日. 5. 肖书奇,马志倩,王天宇,田阳升,李爽. 一种基于PEDV N蛋白特异性纳米抗体的阻断ELISA的检测方法及其应用. ZL201910233889.0. 专利授权日:2020年11月17日. 6. 郑海学,王丽娟,田宏,石正旺,罗俊聪,杨波,张克山,茹毅,李丹,杨帆,一种抗非洲猪瘟病毒的ScFv抗体及其制备方法. ZL201911283478.9. 专利授权日:2020年11月3日. 7. 郑海学,王丽娟,田宏,石正旺,罗俊聪,杨帆,一种抗非洲猪瘟病毒的单链抗体及其制备方法和用途. ZL202010412676.7. 专利授权日:2021年7月2日. 8. 郑海学,王丽娟,田宏,石正旺,罗俊聪,杨波,张克山,茹毅,李丹,杨帆,一种抗非洲猪瘟病毒的ScFv抗体VH-VLλ6及其制备方法. ZL202011452597.5. 专利授权日:2021年7月16日. 9. 郑海学,王丽娟,田宏,石正旺,罗俊聪,杨波,张克山,茹毅,李丹,杨帆一种抗非洲猪瘟病毒的ScFv抗体VH-VLλ11及其制备方法. ZL202011452599.4. 专利授权日:2021年7月20日. 10. 肖书奇,李爽,闫云欢,张晓彬. 一种抗PRRSV感染的猪源miR-c89及其应用. ZL201811583181.X. 专利授权日:2022年04月15日. 11. 肖书奇,李爽,张晓彬. 一种DICER1基因及其siRNA的应用. ZL201811584728.8. 专利授权日:2022年04月15日. 12. 李爽,肖书奇,张晓彬,闫云欢. 一种RXR基因及其siRNA的应用. ZL201811583462.5. 专利授权日:2022年02月11日. 13. 肖书奇,郑紫方,郑海学,凌雪,李洋,冯英桐,马志倩,李志伟. 罗格列酮在制备预防或治疗猪繁殖与呼吸综合征药物中的应用. ZL202310061829.1. 专利授权:2024年2月13日 14. 肖书奇,郭旭阳,郑海学,赵晓静,马志倩,李志伟,李洋,郑紫方,冯英桐. 化合物Thapsigargin在制备预防或治疗猪流行性腹泻药物中的应用. ZL202310056966.6. 专利授权日:2024年03月26日. 15. 肖书奇,郭旭阳,郑海学,赵晓静,马志倩,李志伟,李洋,郑紫方,冯英桐. 化合物EGTA在制备预防或治疗猪流行性腹泻药物中的应用. ZL202310060966.3. 专利授权日:2024年03月26日. 1. 国家自然科学基金面上项目:猪繁殖与呼吸综合征病毒与其继发感染的绿色气球菌相互作用的分子机制(32172846),2022.01-2025.12,58万元。 2. 国家自然科学基金面上项目:宿主miR-10a的调控网络及其调控PRRSV感染与复制的分子机制(31772764),2018.01-2021.12,61万元。 3. 国家自然科学基金面上项目:血红素加氧酶1抑制猪繁殖与呼吸综合征病毒复制的分子机制(31472173),2015.01-2018.12,83万元。 4. 国家重点研发计划项目子课题:畜禽重要免疫抑制性病原的免疫逃逸机制-病原诱导畜禽免疫功能紊乱与继发感染的分子机理研究-PRRSV继发感染过程中黏附相关宿主蛋白的作用机制(2022YFD1800304-06),2022.11-2025.12,40万元。 5. 国家重点研发计划项目子课题:动物重大疫病新概念防控产品研发-动物重大疫病新型广谱中和抗体疫苗研发- PRRSV弱毒株重组PEDV猪源中和抗体疫苗研发(2017YFD0501102),2017.07-2021.06,68万元。 6. 国家重点研发计划项目子课题:猪重要疫病免疫防控新技术研究-规模化猪场科学合理的免疫程序的研究-规模化猪场猪蓝耳病等科学合理的免疫程序的研究(2017YFD0500605),2017.07-2021.06,62万元。 7. 陕西省国际科技合作计划项目-重点项目:PRRSV ADE的关键抗原表位筛选与无ADE的新型疫苗研发(2022KWZ-05),2022.01-2024.12,40万元。 8. 陕西省杰出青年科学基金项目:动物传染病学(2021JC-18),2021.01-2023.12,30万元。 9. 甘肃省联合科研基金重大项目:猪重要病毒性疫病新型疫苗研发(23JRRA1476),2023.10-2026.09,150万元。 10. 甘肃省重大科技专项:家畜重要疫病感染与免疫防控的基础理论研究-猪重要疫病感染与免疫的分子机制研究(课题)(22ZD6NA001),2023.01-2025.12,200万元。 11. 中国农业科学院兰州兽医研究所揭榜挂帅项目:PRRSV和PEDV反向遗传操作系统的建立及其应用(CAAS-ASTIP-JBGS-20210602),2021.09-2024.08,167万元。 12. 中国农业科学院兰州兽医研究所引进人才启动项目:猪重要病毒病防控研究,2022.11-2027.11,600万元。 13. 中国农业科学院青年英才项目,2024.01-2028.12,400万元。 14. 兰州大学动物医学与生物安全学院建设发展基金-山东信得科研项目:可诱导高效中和抗体的重组PRRSV毒株创制(071100015),2023.06-2024.06,150万元。 课题组现有人员8人,其中,课题组长(独立PI )1人,博士研究生6人(独立培养1人、 联培5人)、硕士研究生1人(联培)。 目前主要围绕动物重要DNA病毒开展病原学、致病机制及与宿主相互作用等方面的基础研究,同时开发针对动物病毒的新型疫苗技术与新型抗病毒小分子药物,具体包括以下三个方向: (1)病毒关键受体与宿主因子(限制因子)的筛选与鉴定:围绕重要DNA病毒,利用CRSIPR-Cas9文库、限制因子文库等系统筛选病毒关键宿主因子并探索其作用的分子机制,为抗病育种提供理论基础与潜在靶点; (2)猪获得性免疫与病毒性免疫抑制病:研究猪淋巴细胞分化与调节机制;探索猪烈性病毒与免疫抑制性病毒抑制获得性免疫的分子机制,挖掘病毒逃逸获得性免疫的关键病毒分子与宿主靶点; (3)猪病毒病相关技术研究:围绕重要DNA病毒基础研究中的难点针对性开发与建立相应的技术方法,推动猪DNA病毒的基础研究。 张石磊 课题组PI,研究员,博士生导师,中国农业科学院兰州兽医研究所青年英才入选者,家畜疫病病原生物学研究中心(全国重点实验室)独立PI。分别在瑞典分子感染医学实验室和美国加州大学洛杉矶分校从事病毒学与免疫学方面的博士后研究工作,入选国家级人才工程项目(青年)、中国农科院杰出青年英才等人才计划。 电子邮箱:zhangshilei@caas.cn 课题组主持的科研项目包括国家级人才工程项目(青年)、中国农业科学院杰出青年英才项目、中国农业科学院青年创新项目、中国农科院创新工程中心重大任务课题等。 课题组现有人员10人,其中,课题组长(独立PI )1人、博士研究生1人、硕士研究生5人,助理3人。 1. 病毒非受体依赖性感染与传播机制研究 2. 病毒免疫逃逸与宿主抗病毒机制研究 3. 动物传染病与人畜共患病防控技术研究 1. Nie Z, Zhai F, Zhang H, Zheng H, Pei J. The multiple roles of viral 3Dpol protein in picornavirus infections. Virulence. 2024 Dec;15(1):2333562. 2. Pei J, Beri NR, Zou AJ, Hubel P, Dorando HK, Bergant V, Andrews RD, Pan J, Andrews JM, Sheehan KCF, Pichlmair A, Amarasinghe GK, Brody SL, Payton JE, Leung DW. Nuclear-localized human respiratory syncytial virus NS1 protein modulates host gene transcription. Cell Rep. 2021 Oct 12;37(2):109803. 3. Pei J, Wagner ND, Zou AJ, Chatterjee S, Borek D, Cole AR, Kim PJ, Basler CF, Otwinowski Z, Gross ML, Amarasinghe GK, Leung DW. Structural basis for IFN antagonism by human respiratory syncytial virus nonstructural protein 2. Proc Natl Acad Sci U S A. 2021 Mar 9;118(10):e2020587118. 4. Pei J, Deng J, Ye Z, Wang J, Gou H, Liu W, Zhao M, Liao M, Yi L, Chen J. Absence of autophagy promotes apoptosis by modulating the ROS-dependent RLR signaling pathway in classical swine fever virus-infected cells. Autophagy. 2016 Oct 2;12(10):1738-1758. 5. Pei J, Zhao M, Ye Z, Gou H, Wang J, Yi L, Dong X, Liu W, Luo Y, Liao M, Chen J. Autophagy enhances the replication of classical swine fever virus in vitro. Autophagy. 2014 Jan;10(1):93-110. 6. Merritt TN, Pei J, Leung DW. Pathogenicity and virulence of human respiratory syncytial virus: Multifunctional nonstructural proteins NS1 and NS2. Virulence. 2023 Nov 15:2283897. 7. Ma X, Luo Z, Song R, Nian X, Choudhury SM, Ru Y, Yang F, Zhang Y, Zeng Z, Cao W, Pei J, Liu X, Zheng H. The Foot-and-Mouth Disease Virus Lb Protease Cleaves Intracellular Transcription Factors STAT1 and STAT2 to Antagonize IFN-β-Induced Signaling. J Immunol. 2023 Feb 1;210(3):283-296. 8. Ding M, Dang W, Liu H, Xu F, Huang H, Sunkang Y, Li T, Pei J, Liu X, Zhang Y, Zheng H. Combinational Deletions of MGF360-9L and MGF505-7R Attenuated Highly Virulent African Swine Fever Virus and Conferred Protection against Homologous Challenge. J Virol. 2022 Jul 27;96(14):e0032922. 9. Ma X, Zhang K, Luo Z, Nian X, Choudhury SKM, Zhu Z, Song R, Pei J, Huo Y, Li Y, Yang F, Cao W, Liu H, Liu X, Zheng H. FMDV 3A Antagonizes the Effect of ANXA1 to Positively Modulate Viral Replication. J Virol. 2022 Jun 22;96(12):e0031722. 10. Choudhury SM, Ma X, Zeng Z, Luo Z, Li Y, Nian X, Ma Y, Shi Z, Song R, Zhu Z, Cao W, Pei J, Zheng H. Senecavirus a 3D Interacts with NLRP3 to Induce IL-1β Production by Activating NF-κB and Ion Channel Signals. Microbiol Spectr. 2022 Apr 27;10(2):e0209721. 11. 陈娇,王亚娟,陈志华,茹毅,郑海学,裴晶晶.呼吸道合胞病毒NS1蛋白鼠单克隆抗体的制备应用[J/OL].生物工程学报. 12. 王亚娟,陈娇,陈志华,茹毅,郑海学,裴晶晶.呼吸道合胞病毒NS2蛋白单克隆抗体的制备及初步研究[J/OL].病毒学报. 1. 裴晶晶; 汪洋; 郑海学; 陈志华; 翟凤格; 王亚娟; 张钊. 一种O型口蹄疫病毒VP4蛋白T细胞表位多肽及其应用[P].ZL202311248353.9,2024-03-08. 2. 裴晶晶; 汪洋; 郑海学; 陈志华; 翟凤格; 王亚娟; 张钊. 一种O型口蹄疫病毒VP1蛋白T细胞表位多肽及其应用[P].ZL202311025635.2,2024-04-12. 3. 裴晶晶; 汪洋; 郑海学; 陈志华; 翟凤格; 王亚娟; 张钊. 一种O型口蹄疫病毒VP2蛋白T细胞表位多肽及其应用[P].ZL202311262920.6,2024-04-16. 1. 国家重点研发计划项目:口蹄疫病毒对抗原递呈功能的影响及其分子机制,2021.05-2025.12年,175万元 2. 中国农业科学院兰州兽研究所青年英才项目,2021.07-2026.06,200万元 3. 甘肃省基础研究创新群体项目:猪重要烈性病毒传播与免疫逃逸基础研究创新群体,2024.07-2027.06,60万元 4. 甘肃省陇原青年创新创业人才(团队)项目:FMDV抑制宿主抗原递呈功能的病毒蛋白筛选及功能鉴定,2024.06-2025.05,20万元 围绕抗原递呈细胞的内外部环境特点、特定细胞膜的免疫及靶向特性等,设计并合成一系列高效低毒的新型智能纳米疫苗佐剂,并探索其在体内外传递效率及治疗潜力。 师玉婷 女,汉族,甘肃兰州人,博士,副研究员(所聘),2015年于兰州城市学院获工学学士学位,2018年于兰州大学获理学硕士学位,2020年于兰州大学获理学博士学位,2020年9月至今在中国农业科学院兰州兽医研究所从事智能型纳米疫苗的制备。现主要从事环境响应性纳米疫苗的构筑及其在生物医药领域中的应用研究。以第一或并列第一作者在Adv. Funct. Mater.、Carbohydr.Polym.、Chem Commun.等期刊上发表SCI 论文6篇。主持国家自然科学基金青年基金:ROS激活ASFV特异性T细胞免疫反应纳米疫苗的制备(22305266),2024.1-2027.12,30万元。 电子邮箱:shiyuting@caas.cn 1. Yuting Shi; Wenwen Yu; Xiaoqin Liang; Ju Cheng; Yufei Cao; Mingsheng Liu; Yu Fang; Zheng Yang; Hongbin Liu; Hua Wei; Guanghui Zhao ; Interpenetrating network expansion sponge based on chitosan and plasma for ultrafast hemostasis of arterial bleeding wounds, Carbohydrate Polymers,2023, 307: 120590; 2. Yuting Shi; Yufei Cao; Ju Cheng; Wenwen Yu; Mingsheng Liu; Juanjuan Yin; Congshu Huang; Xiaoqin Liang; Haicun Zhou; Hongbin Liu; Zheng Yang; Yu Fang; Hua Wei; Guanghui Zhao; Construction of Self-Activated Nanoreactors for Cascade Catalytic Anti-Biofilm Therapy Based on H2O2 Self-Generation and Switch-on NO Release Advanced Functional Materials, 2022, 32(20): 2111148. 国家自然科学基金青年基金:ROS激活ASFV特异性T细胞免疫反应纳米疫苗的制备((22305266)),2024.1-2027.12,30万元。
一、组织架构

二、中心职责
(一)科研平台运行管理
(二)独立PI课题组管理服务
(三)人才引育与科研攻关
(四)中心仪器室运行管理
(五)所领导交办的其他工作
三、现任领导
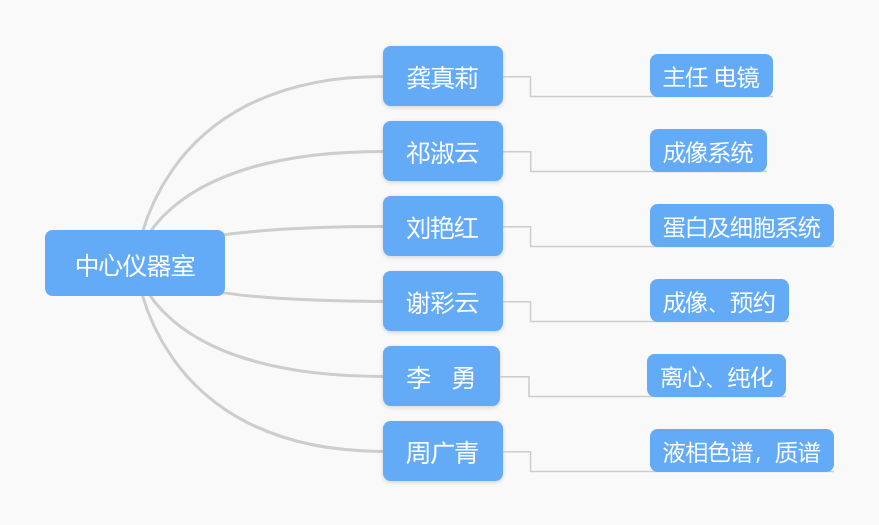
四、人员情况

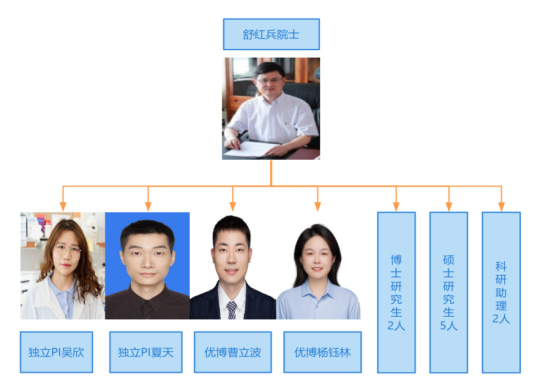
(一)Shu Lab
人员情况
人员简介





研究进展或成果
科研项目
(二)肖书奇课题组
人员情况
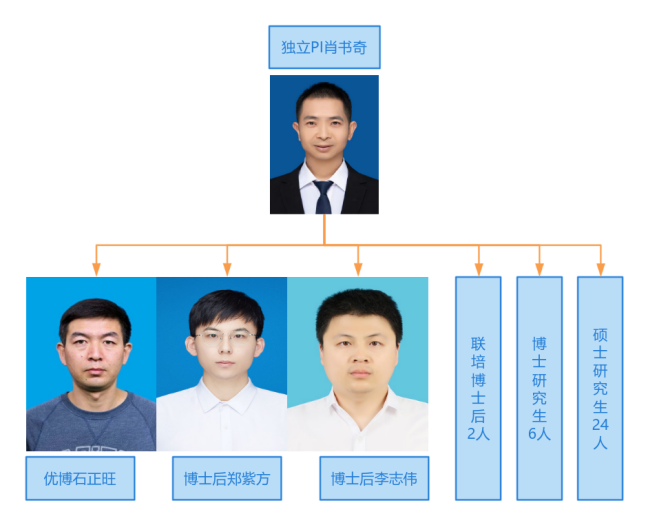
研究方向及内容
人员简介



科研项目
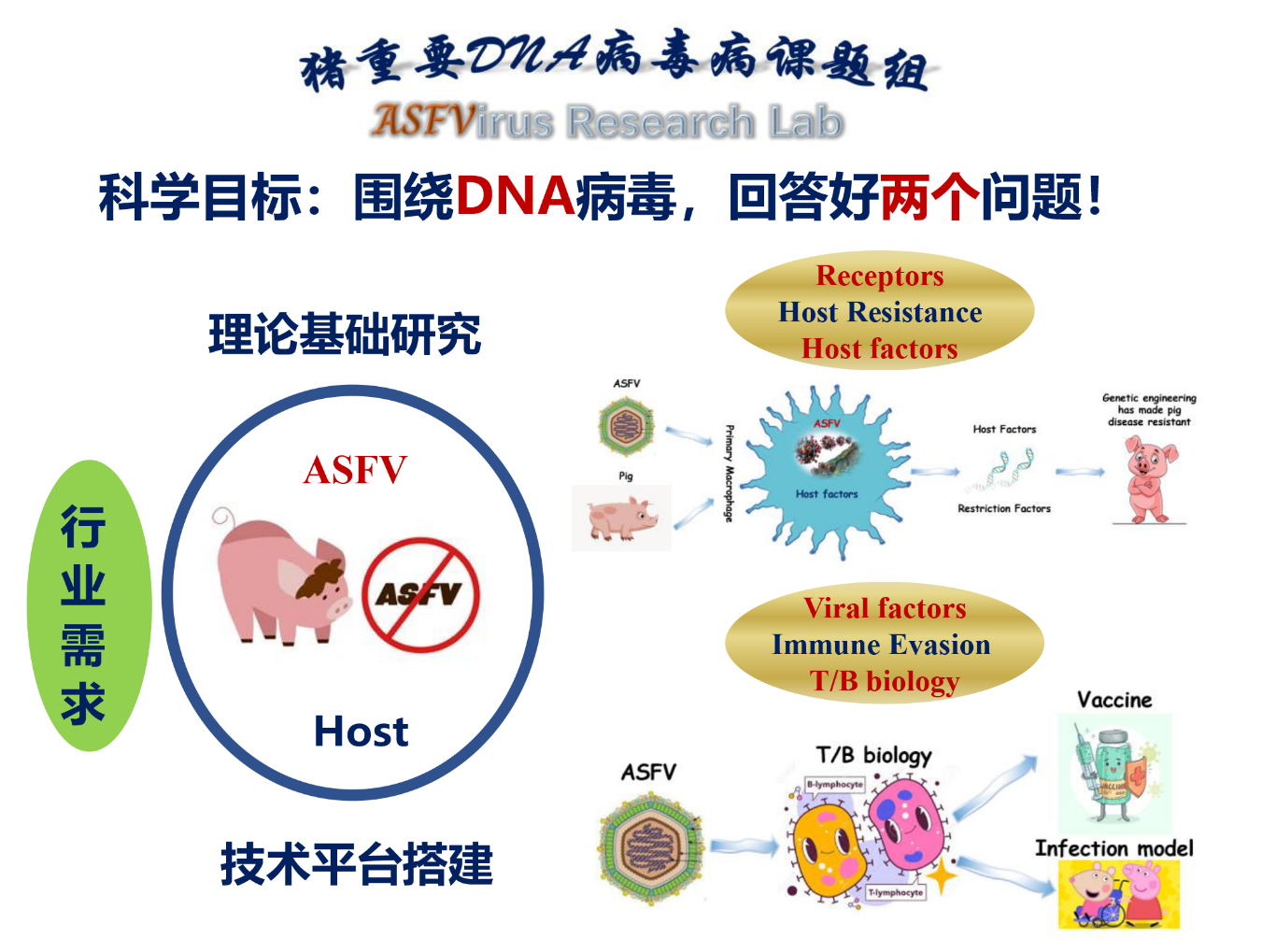
(三)张石磊课题组
人员情况
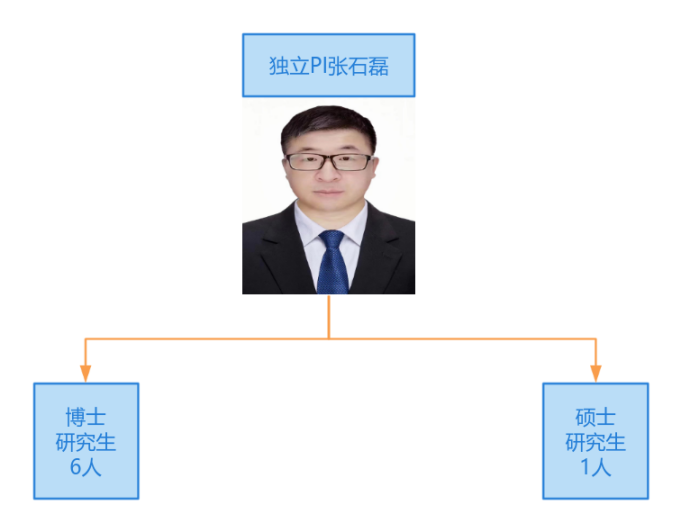
研究方向及内容
人员简介

科研项目
(四)裴晶晶课题组
人员情况
研究方向及内容
研究进展或成果
论文
专利
科研项目
(五)师玉婷组
研究方向及内容
人员简介

研究进展或成果
科研项目