近日,中国农业科学院兰州兽医研究所猪重要疫病防控研究课题组发现宿主细胞感知猪繁殖与呼吸综合征病毒(PRRSV)感染后通过转录因子阴阳1(YY1)调控脂代谢基因的表达重编程细胞内的脂滴(LD)合成进而发挥抗病毒功能。相关研究结果以“Host cells reprogram lipid droplet synthesis through YY1 to resist PRRSV infection”为题,发表于《mBio》期刊。
PRRSV自上世纪80年代末发现以来已流行30余年,对全球养猪业造成了不可估量的经济损失。然而,传统疫苗不能提供令人满意的保护。病毒作为寄生病原,高度依赖宿主细胞进行复制增殖,从细胞角度挖掘宿主对抗PRRSV感染的新策略,对更深入地理解PRRSV的感染与复制机制并发掘新型有效防控靶点具有重要意义。
该研究发现PRRSV感染后,转录因子YY1在猪体内和体外的表达水平均显著上调。敲低或敲除YY1促进PRRSV复制,而过表达YY1在猪体内和体外抑制PRRSV复制。YY1虽然正调控IFN-β的表达,但在敲除IFN-β的受体IFNAR1的条件下敲低YY1依旧促进PRRSV复制,表明YY1正调控IFN-β不是其抑制PRRSV复制的主要途径。脂滴是细胞内的能量储存中枢,其代谢产物脂肪酸是包括SARS-CoV-2、DENV、HCV和PRRSV等众多病毒复制所需的能量供体。进一步研究发现,PRRSV感染后细胞内的LD数量增多,但PRRSV不依赖LD进行子代病毒粒子的组装。敲除YY1抑制LD合成而过表达YY1促进LD合成,且外源诱导LD合成抑制PRRSV复制,表明PRRSV感染后合成增多的LD是宿主细胞应对PRRSV感染的一种防御策略,而YY1在该过程中发挥关键作用。YY1通过负调控脂肪酸合酶(FASN)介导的脂肪酸合成途径,正调控过氧化物酶体增殖体激活受体γ(PPARγ)介导的LD合成途径,从而抑制PRRSV复制。
该研究首次揭示了宿主细胞重编程LD合成抑制PRRSV复制的分子机制,有助于理解正常生理条件下LD与PRRSV之间对抗与利用并存的动态互作关系,并从脂滴介导抗病毒反应的层面为PRRSV新型防控靶点的发掘提供参考。
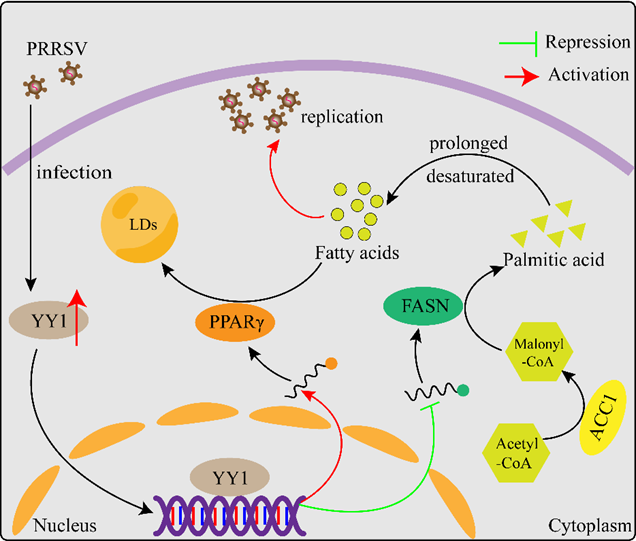
图1 宿主细胞重编程脂滴合成抑制PRRSV复制的机制示意图
中国农业科学院兰州兽医研究所肖书奇教授为本文通讯作者,郑紫方博士、博士研究生凌雪和李洋博士为本文共同第一作者。该研究得到国家自然科学基金、国家重点研发计划、甘肃省重大科技专项等项目资助。
原文链接:https://doi.org/10.1128/mbio.01549-24